Vídeos PROPRIEDADES COLIGATIVAS das SOLUÇÕES

Vídeo 01
http://www.youtube.com/watch?v=VSZhBna03bY
Vídeo 02
http://www.youtube.com/watch?v=xh2qpI7Pi70&feature=related
Vídeo 03
http://www.youtube.com/watch?v=keymnhXrzjA&feature=related
Vídeo 04
http://www.youtube.com/watch?v=JxzFssficw4&feature=related
Bom trabalho!!!
1°=O video esplica detalhadamente como ocorre as ligassoes quimicas e esplica pq os elementos buscam ce assemelhar com os gases nobres e ficarem estaveis.Apresemta regras pratias de serem ceguidas para ligasão covalente e ionica.
ResponderExcluir2°=Ligação covalente da agua esplicada detalhadamente como a estrutura de lewis ,formula estrutural e formula molecular.ligaçoes simples, duplas e triplas como ex o hidrogenio,oxigenio e nitrogenio respequivamente.
3°=O oleo e menos denso q o papel com grafit e a agua e mais densa q o papel e o oleo.
4°=Demostra aplicassoes praticas sobre osmose.
Skarllety Joyce 2 ano Turma 200
ResponderExcluir1 video- LIGAÇÃO QUÍMICA É UMA INTERAÇÃO (ATRAÇÃO) ENTRE ÁTOMOS QUE VISA A ESTABILISAÇÃO DE AMBOS OS ÁTOMOS ENVOLVIDOS.
PODE OCORRER ATRAVÉS DA TRANSFERÊNCIA DE ELÉTRONS, FORMAÇÃO DE ÍONS E UNIÃO ELETROSTÁTICA (UNIÃO ENTRE CARGAS) ENTRE ELES OU ATRAVÉS DO COMPARTILHAMENTO DE ELÉTRONS ENTRE ELES. AINDA EXISTE A LIGAÇÃO METÁLICA ONDE ELÉTRONS E ÍONS METÁLICOS INTERAGEM ENTRE SI SOB AÇÃO DE ATRAÇÃO E REPULSÃO
2 vídeo- Nessa ligação, os átomos são unidos devido ao compartilhar de seus elétrons, surgem então os pares eletrônicos indicados pelo círculo:
Ligação covalente molecular de dois átomos de Cloro (Cl).
Cada par eletrônico formado pertence simultaneamente aos dois átomos. As moléculas são estruturas eletricamente neutras porque não ocorre nem ganho nem perda de elétrons, apenas o compartilhamento.
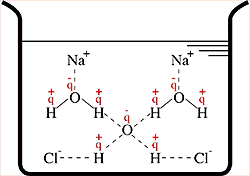
A água é um composto molecular constituído por dois átomos de hidrogênio (H2) e um de oxigênio (O).
3 video- fala sobre densidades de grafite oleo agua e papel.
4- explicação sobre OSMOSE
Amanda Queiroz 2 ano Turma 200
ResponderExcluirPropriedades coligativas:são as propriedades das soluções que dependem do número de partículas dispersas e independem da natureza das partículas do soluto.
Pressão Máxima de Vapor: é a pressão exercida pelo vapor quando está em equilíbrio dinâmico com o liquido correspondente.A PMV depende da temperatura e da natureza do líquido. Observa-se experimentalmente que, numa mesma temperatura, cada líquido apresenta sua pressão de vapor, pois esta está relacionada com a volatilidade do líquido.
Ponto de ebulição é a temperatura na qual a PMV iguala a pressão atmosférica. Quanto maior a PMV na temperatura ambiente, menor o P.E.
Osmose e Pressão Osmótica
Osmose é passagem de um solvente para o interior de uma solução feita desse mesmo solvente, através de uma membrana semipermeável. A osmose é também uma propriedade coligativa das soluções, pois depende do número de partículas dissolvidas
Tipos de membranas:
Permeáveis: são aquelas que permitem a passagem tanto do solvente como do soluto.
Semipermeáveis: são aquelas que permitem apenas a passagem do solvente.
Impermeáveis: são aquelas que não permitem a passagem de soluto e solvente.
O fluxo de solvente ocorre da solução mais diluída para a solução mais concentrada
Pressão Osmótica: é a pressão que se deveria aplicar sobre a solução, a determinada temperatura, para impedir a passagem do solvente através da membrana.
Emanuela Alves - 2º Ano - Turma 200
ResponderExcluirIrei falar dos quatro vídeos em conjunto, eles mostram que existem quatro propriedades coligativas que são: o abaixamento da pressão de vapor do solvente (tonoscopia), o aumento do seu ponto de ebulição (ebulioscopia), o abaixamento do seu ponto de congelamento (crioscopia) e a osmose (osmoscopia - só depende da quantidade de soluto e solvente).
Ensina também a fazer diversos cálculos como o do número de partículas dispersas se eles dissociam ou não dissociam e nos diz que os terminados em “ose” não dissociam. A água com açúcar ou com sal vai ferver em uma temperatura mais do que a água sem esses dois componentes. A diferença nas concentrações do soluto dentro e fora da célula da origem a pressão osmótica a água passa para a solução mais concentrada no interior da célula levando moléculas pequenas de nutrientes.
A pressão de vapor de qualquer substancia na sua temperatura de ebulição é igual a pressão ambiente. Efeito Tonoscópico é a pressão máxima de vapor do solvente na solução é menor que a pressão máxima de vapor do solvente puro.
E o ultimo vídeo da melhor definição e aplicações sobre osmose.
Gostei muito desses vídeos por além de explicar mostra imagens que se movimentam e nos dá melhor absorção do conteúdo.
O abaixamento da pressão de vapor do solvente (tonoscopia), o aumento do seu ponto de ebulição (ebulioscopia), o abaixamento do seu ponto de congelamento (crioscopia) e a osmose (osmoscopia - só depende da quantidade de soluto e solvente).
ResponderExcluirOsmose e Pressão Osmótica
Osmose é passagem de um solvente para o interior de uma solução feita desse mesmo solvente, através de uma membrana semipermeável. A osmose é também uma propriedade coligativa das soluções, pois depende do número de partículas dissolvidas
Tipos de membranas:
Permeáveis: são aquelas que permitem a passagem tanto do solvente como do soluto.
Semipermeáveis: são aquelas que permitem apenas a passagem do solvente.
Impermeáveis: são aquelas que não permitem a passagem de soluto e solvente.